لا تؤثر الشيخوخة على خلايا الجسم فحسب ، بل تؤثر أيضا على المصفوفة بين الخلايا المحيطة بها. مع تقدم العمر ، تفقد المصفوفة مرونتها ، وتصبح أكثر صلابة وفي نفس الوقت أقل متانة. العلامات الأولى للشيخوخة التي تلفت الأنظار على الفور: ظهور التجاعيد وفقدان مرونة الجلد ، وزيادة هشاشة العظام ، وانخفاض في حركة المفاصل—ترتبط جميعها بتغيرات لا رجعة فيها تحدث في المصفوفة.
يساهم انخفاض مرونة المصفوفة في تطوير عدد من الأمراض المرتبطة بالعمر. على سبيل المثال ، هناك انتهاكات لجدران الأوعية الدموية ، والأضرار التي لحقت أنسجة القلب والسرطان والأمراض العصبية التنكسية. على المستوى الجزيئي ، تؤدي زيادة صلابة المصفوفة إلى ضعف الاتصال بين المصفوفة والخلايا ، وتتداخل مع عمل الجهاز المناعي ، وتساهم أيضا في الالتهاب المزمن. كل هذه العوامل تساهم بشكل كبير في الشيخوخة في جميع أنحاء الجسم.
ويرتبط الشيخوخة من المصفوفة في المقام الأول مع اضطرابات في البروتينات الهيكلية الرئيسية - الكولاجين والإيلاستين. مع تقدم العمر ، يتناقص عددهم ، وتصبح الألياف أقل تنظيما وأكثر تناثرا وفضفاضة. يساهم عدد من العوامل في هذه العملية ، بما في ذلك تدهور عمل الخلايا التي تصنع مصفوفة جديدة (الخلايا الليفية وبانيات العظم) ، وزيادة عمل البروتينات المعدنية—الإنزيمات التي تدمر المصفوفة القديمة ؛ الأضرار الناجمة عن العوامل البيئية مثل الأشعة فوق البنفسجية والتبغ.
مع تقدم العمر ، يحدث التآكل الميكانيكي للألياف أيضا ، ويتراكم الكالسيوم فيها ، وتحدث الأكسدة بواسطة أنواع الأكسجين التفاعلية. ومع ذلك ، وفقا للدراسات الحديثة ، فإن التغيرات الهيكلية في ألياف الكولاجين والإيلاستين ، المرتبطة بتكوين الروابط المتقاطعة - الروابط الكيميائية التي تربط الألياف المختلفة معا ، تقدم أكبر مساهمة في شيخوخة المصفوفة. يمكن أن تكون هذه الروابط المتقاطعة بمثابة "أصفاد" جزيئية عن طريق ربط البروتينات المجاورة ومنعها من التحرك بشكل مستقل.
يؤدي وجود فائض من الروابط المتقاطعة إلى انتهاك المرونة ، كما يعقد تجديد المصفوفة ، حيث تصبح الألياف المتصالبة مع بعضها البعض أقل سهولة بالنسبة للخلايا والإنزيمات المشاركة في تجديدها.
التشابك في المصفوفة
الكولاجين والإيلاستين بروتينات طويلة العمر. عمر النصف للكولاجين (الوقت الذي يستغرقه نصف مجموعة الجزيئات ليتم تكسيرها) في بعض الأنسجة هو أكثر من مائة عام. وفي الغضروف الفخذي وفي الأقراص الفقرية يصل إلى 200. وهذا يعني أن هذه البروتينات حساسة بشكل خاص لتراكم الضرر ، لأن عملية تجديدها تحدث بمعدل منخفض وتبقى البروتينات التالفة في الجسم لسنوات عديدة.
هناك عدة آليات لتشكيل روابط متقاطعة في بروتينات المصفوفة:
التكوين الأنزيمي للروابط المتقاطعة باستخدام إنزيمات ترانسجلوتاميناز وليسيل أوكسيديز. تحدث هذه العملية عادة أثناء نضوج ألياف المصفوفة ، نظرا لأن كمية معينة من الروابط المتقاطعة ضرورية لتثبيت الألياف. ومع ذلك ، مع تقدم العمر ، هناك تنشيط مفرط لهذه الإنزيمات ، مما يساهم في زيادة تصلب الأنسجة.
لا يتطلب التشابك غير الأنزيمي إنزيمات للعمل وهو أكثر أهمية لعملية الشيخوخة. يحدث باستمرار طوال الحياة و (على عكس الأنزيمية) ، لا رجعة فيه كيميائيا. في معظم الأحيان يحدث من خلال غليكاتيون.
غليكاتيون
غليكاتيون هو ارتباط سكر بسيط (الجلوكوز أو الفركتوز أو المشتقات) ببروتين لتكوين تشابك كيميائي. يحدث هذا التفاعل تلقائيا ولا يتطلب عمل الإنزيمات. بعبارات بسيطة ، هذا هو رد فعل " التصاق السكريات بالبروتينات."غالبا ما نراها في الحياة اليومية ، عندما ، عند الخبز ، يتم الحصول على قشرة على كباب أو خبز. ومع ذلك ، من دون "القلي" إضافية فإنه يستمر أيضا ، فقط أكثر ببطء—وهذا هو بالضبط ما يحدث في جسمنا.
الاسم الكيميائي لهذا التفاعل هو تفاعل ميلارد ، وتسمى المواد الموجودة على قشرة الخبز بالمنتجات النهائية للغليكاتيون ، أو المنتجات النهائيه للغليكاتيون AGEs. محدود بمعنى أن رد الفعل لا رجعة فيه ، والقشرة لن تتحول أبدا إلى خبز خام.يعد وجود المنتج النهائي للغليكاتيون في أجسامنا مشكلة خطيرة ، لأن البروتينات المنصهرة بالسكريات تتوقف عن أداء وظائفها ، ولم تعد قادرة على العودة إلى حالتها الوظيفية الطبيعية. المنتج النهائي للغليكاتيون(AGE) هو القمامة التي يجب التخلص منها ، حيث يؤدي تراكمها إلى عدد من الأمراض ، مما يؤدي إلى زيادة مستوى الالتهاب في الجسم.
يمكن اعتبار غليكاتيون كنوع من "تأكل" الكيميائية من البروتينات. هذه عملية عشوائية عشوائية تحدث في أجسامنا دون أي برنامج وراثي. السكريات (الجلوكوز ، الفركتوز ، الجالاكتوز) هي مصادر الطاقة لجميع الخلايا ، ووجودها في الدم ضروري للنشاط الحيوي للجسم. وهكذا ، يمكن اعتبار غليكاتيون كمنتج ثانوي لوجود السكريات في الدم.
مع تقدم العمر ، تؤدي عمليات السكر إلى مجموعة متنوعة من العواقب المرضية. غليكاتيون هو سبب معظم تلف الأنسجة في مرض السكري. يمكن أن يؤدي إلى خلل في الميتوكوندريا. تسريع عملية تنكس الخلايا العصبية في مرض باركنسون;
تم العثور على محتوى متزايد من المنتجات النهائيه للغليكاتيون في الخلايا العصبية للمرضى الذين يعانون من مرض الزهايمر.
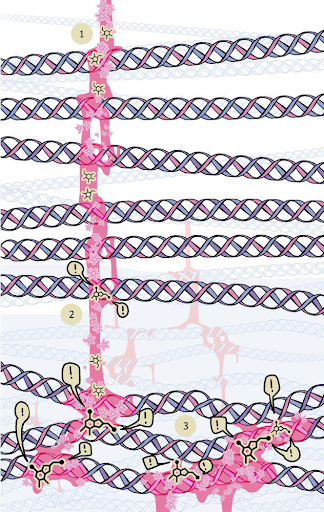
الشكل 1: التمثيل التخطيطي لعملية سكر البروتين: التعلق غير الأنزيمي للسكريات الأحادية (1) بالمجموعة الأمينية الحرة للبروتين (2). علامات التعجب (!) تدل على الأماكن التي تشكلت فيها الغرز.
من وجهة نظر كيميائية ، يحدث تفاعل ميلارد على عدة مراحل. في المرحلة الأولى ، يهاجم السكر المجموعة الأمينية الحرة من اللايسين أو الأرجينين (وهي جزء من البروتين) مع التكوين اللاحق لقاعدة شيف. ثم يتم تشكيل منتج أمادوري ، والذي يتحول ، خلال العديد من التحولات ، إلى ثنائي كربونات ، مما يؤدي إلى تكوين تشابك. من المهم أن نلاحظ أنه في المراحل الأولى يكون رد الفعل قابلاً للانعكاس ، ومع ذلك ، في المراحل النهائية (أثناء تكوين المنتجات النهائيه للغليكاتيون ذات البنية الدورية) ، لا يمكن لأي إنزيم واحد في الجسم تفكيكها.
يمكن تشكيل أنواع مختلفة من المنتجات النهائيه للغليكاتيون نتيجة تفاعل ميلارد. وأكثرها شيوعا هي تعديلات الكولاجين مثل الجلوكوزيبان ، البنتوسيدين ، كربوكسي إيثيل ليسين ، كروسلين ، فيسبيرليسين ، والعفن. يعتمد نوع المنتج النهائي للغليكاتيون
على العديد من العوامل ، على سبيل المثال ، على مصدر ونوع مجموعة الكربونيل للسكر (التي تهاجم المجموعة الأمينية للبروتين في المراحل المبكرة من تفاعل ميلارد) ؛ نوع الأحماض الأمينية وكذلك الحالة الأيضية للفرد. على سبيل المثال ، لتشكيل الجلوكوزيبان ، يشارك الجلوكوز والليسين والأرجينين في التفاعل.
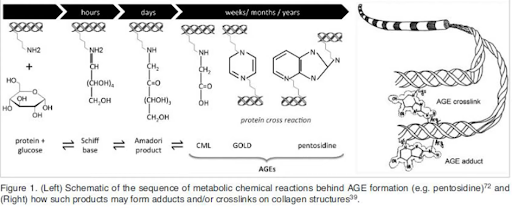
الشكل 2. اليسار: تمثيل تخطيطي لتفاعل ميلارد ، والذي يحدث خلاله تكوين الأعمار (على سبيل المثال ، البنتوسيدين). على اليمين: توضيح كيف يمكن للأعمار أن تشكل روابط متقاطعة و / أو تقرب من هياكل الكولاجين.
من المهم ملاحظة أن الأعمار تستخدم بالفعل في الممارسة السريرية كعلامة تشخيصية لعدد من الأمراض. على سبيل المثال ، يمكن للبروتينات الدهنية عالية الكثافة والمنخفضة الكثافة أن تتنبأ بدقة بتطور أمراض القلب التاجية ، وكذلك ظهور أعراض تصلب الشرايين. يتم استخدام محتوى الجلوكوزيبان في الجلد (واحدة من أكثر الأعمار شيوعا) لتشخيص أمراض القلب والأوعية الدموية وأمراض الجهاز العصبي.
بشكل عام ، فإن الاتجاه الواعد في تطوير التشخيص التنبؤي لجليكاتيون البروتين هو مزيج من عدد كبير من التحليلات المختلفة في تركيبة مع تقنيات التعلم الآلي. بالفعل ، تظهر هذه الأساليب نتائجها الأولى في تشخيص مرض التوحد.
تشابك المصفوفة كمسار للشيخوخة
يؤدي التكوين العشوائي للروابط المتقاطعة إلى تراكم الضرر المعتمد على العمر في بروتينات المصفوفة. في فترة الطفولة ، تكون هذه الإصابات غير مرئية ، حيث يتم تعويضها عن طريق بروتينات جديدة مركبة بنشاط من المادة بين الخلايا وزيادة في حجم الكائن الحي بأكمله. ومع ذلك ، بعد البلوغ وتوقف النمو ، يبدأ تراكم الروابط المتقاطعة في المساهمة أكثر فأكثر في تدهور الصحة في الجسم.
تكمن طبيعة تكوين الروابط المتقاطعة في مجال الجمع غير الأنزيمي للبروتينات مع السكريات القادمة من الدم. في الوقت نفسه ، لا يحتوي جسم الإنسان على أنظمة إنزيمية تسمح له بفصل الروابط المتقاطعة عن بروتينات المادة بين الخلايا. الطريقة الوحيدة المتاحة هي تفكيك جزيء البروتين بأكمله بواسطة مصفوفة الكولاجين أو البروتينات. ولكن هذه عملية مستهلكة للطاقة ومستهلكة للعمالة وبطيئة، والتي لا تسمح بالتعويض عن جميع الروابط المتقاطعة الناتجة.
علاوة على ذلك ، فإن كفاءة تحلل الكولاجيناز للكولاجين غير المترابط أعلى بكثير من كفاءة البروتينات التالفة. وهكذا ، تبدأ الإنزيمات أولا في تدمير الكولاجين الأقل ارتباطا ، وتدمر فقط تلك التي تحتوي على نسبة عالية من السكر في النهاية. ونتيجة لذلك ، تقل كمية الكولاجين والألياف المرنة في المصفوفة القديمة ، وتلك التي تبقى عالية السكر. تزداد هشاشة وصلابة ألياف المصفوفة.
يؤدي تفاعل المصفوفة القديمة مع الخلايا المحيطة إلى عدد من العمليات المرضية ، بما في ذلك انخفاض في انقسام الخلايا الجذعية ، وضعف هجرة الخلايا والإشارات بين الخلايا ، وكذلك الالتهاب المزمن ، مما يحفز في النهاية ظهور مجموعة واسعة من الأمراض المرتبطة بالعمر ويساهم في الشيخوخة بشكل عام.
أحد الجوانب المهمة لشيخوخة المصفوفة هو السرعة البطيئة والعملية متعددة الخطوات لتحويل جزيء السكر والأحماض الأمينية إلى جزيء العمر النهائي والمستقر كيميائيا. في مراحل مختلفة من هذه العملية ، مثل مرحلة تكوين منتج قواعد أمادوري وشيف ، يمكن منع حدوث التشابك المستقبلي من الناحية الدوائية بواسطة عوامل مضادة للغليكاتيون. تطورها هو واحد من أهم مهام علم الشيخوخة الحديث.
